 Gemini 생성이미지
Gemini 생성이미지
신장은 우리 몸의 노폐물을 걸러내는 정수기 역할을 하는 중요한 장기다. 그러나 이 고요한 장기 속에 수많은 물집(낭종)이 포도송이처럼 생겨나 서서히, 그리고 확실하게 기능을 마비시키는 질환이 있다. 바로 '상염색체 우성 다낭성 신장병(Autosomal Dominant Polycystic Kidney Disease, 이하 ADPKD)'이다.
ADPKD는 전 세계적으로 가장 흔한 유전성 신장 질환으로, 약 1,000명에서 2,500명당 1명꼴로 발병한다. 국내 유병률 역시 이와 유사하여 약 1만 명 이상의 환자가 있는 것으로 추산되나, 진단받지 못한 잠재 환자까지 포함하면 그 수는 훨씬 더 많을 것으로 예상된다. 본지는 ADPKD의 발병 원인부터 유전 양상, 최신 치료 트렌드 및 통계적 현황까지 심층적으로 조명한다.
ADPKD는 이름에서 알 수 있듯 유전자 변이에 의해 발생한다. 가장 핵심적인 원인은 PKD1유전자와 PKD2 유전자의 돌연변이다. 이 유전자들은 신장 세뇨관 세포에 존재하는 일차 섬모(Primary Cilia)의 형성과 기능을 조절하는 단백질인 '폴리시스틴(Polycystin)'을 만드는 데 관여한다.
섬모는 세포 외부의 환경을 감지하는 안테나 역할을 한다. 유전자 변이로 인해 이 안테나가 망가지면 세포 내 칼슘 농도 조절에 실패하고, 세포 내 신호 전달 체계(cAMP 경로)가 과활성화된다. 이로 인해 세포가 비정상적으로 증식하고 액체를 분비하게 되어 낭종(Cyst)이 형성된다.
전체 환자의 약 85%는 16번 염색체에 위치한 PKD1 유전자의 변이로 인해 발생하며, 나머지 약 15%는 4번 염색체에 있는 PKD2 유전자의 변이에 기인한다. 임상적으로 PKD1 변이 환자가 PKD2 변이 환자보다 병의 진행 속도가 훨씬 빠르다. 통계적으로 PKD1 환자는 평균 54세경에 투석이 필요한 말기 신부전(ESRD)에 도달하는 반면, PKD2 환자는 74세경에 도달하는 것으로 보고된다.
ADPKD는 '상염색체 우성' 유전 방식을 따른다. 이는 성별에 관계없이 부모 중 한 명이 질환을 앓고 있다면 자녀에게 유전될 확률이 정확히 50%라는 것을 의미한다. 보인자 개념이 없어 세대를 건너뛰지 않고 매 세대 연속적으로 나타나는 것이 특징이다.
그러나 모든 환자가 부모로부터 유전되는 것은 아니다. 전체 환자의 약 5~10%는 부모에게 물려받은 것이 아니라, 본인 대에서 처음으로 유전자 돌연변이가 발생하는 '산발성 변이(De novo mutation)' 케이스다. 따라서 가족력이 없다고 해서 ADPKD의 가능성을 완전히 배제할 수는 없으며, 건강검진상 다발성 낭종이 우연히 발견된다면 반드시 정밀 검사를 받아야 한다.
ADPKD는 신장에 국한된 병이 아닌 전신 질환이다. 낭종은 신장 외에도 간, 췌장, 비장 등 다른 장기에도 발생할 수 있으며 혈관 이상을 동반하기도 한다.
정상적인 신장은 주먹 크기에 무게는 약 150g 정도다. 그러나 ADPKD 환자의 신장은 수많은 낭종으로 인해 축구공만큼 커지기도 하며, 심한 경우 무게가 수 kg에 달하기도 한다. 이러한 비대는 복부 팽만감, 소화 불량, 옆구리 통증을 유발한다. 초기에는 신장의 보상 기전으로 사구체 여과율이 정상으로 유지되지만, 낭종이 정상 조직을 거의 다 잠식하는 40대 이후부터 급격히 기능이 뚝 떨어진다.
가장 주의해야 할 신장 외 합병증은 뇌동맥류다. ADPKD 환자의 약 10~20%에서 뇌혈관 벽이 풍선처럼 부풀어 오르는 뇌동맥류가 발견된다. 일반인보다 5배 이상 높은 빈도이며, 특히 뇌동맥류나 뇌출혈의 가족력이 있는 경우 그 위험성은 배가된다. 파열 시 지주막하 출혈로 사망에 이를 수 있으므로, 진단 초기 및 정기적인 MRA(자기공명혈관조영술) 선별 검사가 필수적으로 권고된다.
과거에는 초음파상 보이는 낭종의 개수(Ravine criteria)가 주요 진단 기준이었다. 30대까지는 양측 합쳐 3개 이상, 60세 이상은 각 신장당 4개 이상 등의 기준이 사용된다.
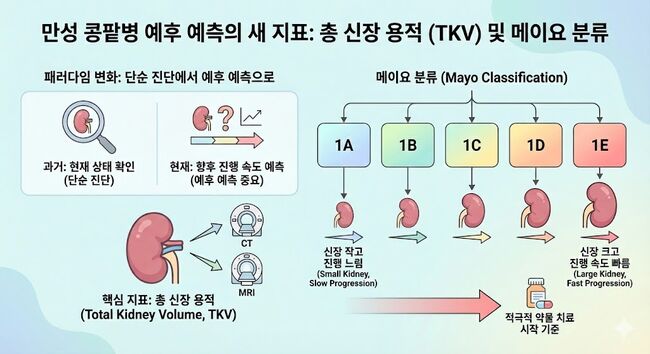
하지만 최근에는 단순 진단을 넘어, 향후 신장 기능이 얼마나 빨리 나빠질지를 예측하는 것이 더 중요해졌다. 이에 따라 CT나 MRI로 측정한 '총 신장 용적(Total Kidney Volume, TKV)'이 핵심 지표로 떠올랐다. 환자의 키를 보정한 신장 크기를 기준으로 예후를 1A부터 1E까지 5단계로 나누는 '메이요 분류(Mayo Classification)'가 그것이다. 1E 등급에 가까울수록 신장이 크고 진행 속도가 빠르다는 뜻이며, 이는 적극적인 약물 치료를 시작하는 기준이 된다.
 Gemini 생성 이미지
Gemini 생성 이미지
불과 10년 전만 해도 ADPKD의 치료는 고혈압 조절과 저염식 등 보존적 요법에 그쳤다. 그러나 낭종의 성장을 억제하는 표적 치료제 '톨밥탄(Tolvaptan)'의 등장으로 질병 경과를 바꾸는 것이 가능해졌다.
톨밥탄은 신장에서 수분 재흡수를 담당하는 바소프레신 V2 수용체를 차단한다. 바소프레신은 낭종 내로 물을 채우고 세포를 증식시키는 역할을 하는데, 이를 억제함으로써 낭종의 성장 속도를 늦추고 신장 기능 저하를 지연시킨다. 대규모 임상 연구(TEMPO 3:4, REPRISE) 결과, 톨밥탄 투여군은 위약군 대비 신장 크기 증가 속도와 기능 감소 속도가 유의미하게 둔화되었다.
약리 기전상 소변량이 급격히 늘어나는 다뇨, 빈뇨, 야간뇨가 발생하며 극심한 갈증을 호소하게 된다. 하루 소변량이 4~6L에 달하기도 한다. 또한 일부 환자에서 심각한 간 독성이 보고되어, 투약 초기에는 매달 간 기능 혈액 검사를 받아야 한다.
한국에서는 이 약값이 상당히 고가이므로 건강보험 적용 여부가 중요하다. 현재 국내 급여 기준은 만 18세 이상 만 50세 이하의 환자 중 ▲만성 신장병 1~3단계이면서 ▲빠르게 진행하는 경우(메이요 분류 1C, 1D, 1E 등급 등)에 한해 엄격하게 적용된다. 따라서 조기에 TKV를 측정하여 본인이 급여 대상인지 확인하는 것이 중요하다.
약물 치료 외에도 생활 습관 교정이 필수적이다.
하루 2.5~3L 이상의 물을 마시는 것이 권장된다. 이는 단순히 탈수를 막는 것을 넘어, 혈중 삼투압을 낮춰 바소프레신 분비 자체를 줄이기 위함이다. (단, 신장 기능이 이미 많이 떨어진 말기 환자는 주치의와 상의해야 한다.)
고혈압은 신장 손상을 가속화한다. 수축기 혈압 110~130mmHg 미만을 목표로 하며, 안지오텐신 전환효소 억제제(ACEi)나 안지오텐신 수용체 차단제(ARB)가 1차 치료제로 쓰인다.
소금 섭취는 갈증을 유발하고 혈압을 올리므로 하루 5g 이하로 제한한다. 카페인 역시 낭종 성장을 부추기는 cAMP를 증가시킬 수 있으므로 섭취를 줄이는 것이 좋다.
대한신장학회 데이터에 따르면, ADPKD는 당뇨, 고혈압, 사구체신염에 이어 국내 투석 환자 원인 질환 4위를 차지한다. 유전이라는 피할 수 없는 굴레는 환자와 가족들에게 큰 심리적 부담을 주지만, 의학은 분명 진보하고 있다.
과거에는 "손쓸 수 없는 병"이었지만, 이제는 "관리 가능한 만성 질환"으로 패러다임이 바뀌었다. 핵심은 '타이밍'이다. 신장 기능이 정상일 때 병을 발견하고, 신장 크기를 측정하여 고위험군을 선별한 뒤, 적절한 시기에 표적 치료를 시작한다면 투석 없는 삶, 혹은 투석 시기를 획기적으로 늦춘 삶을 영위할 수 있다.
가족력이 있다면 두려워 말고 검진을 받아야 한다. 침묵하는 낭종이 당신의 콩팥을 잠식하기 전에, 먼저 알고 대처하는 것이 ADPKD를 이기는 유일하고도 확실한 길이다.